 外来
外来
急性期血栓回収術の適応をどう判断するか【医療関係者向け】
2015年のMR CLEAN、ESCAPE, SWIFT PRIME, EXTEND IA, REVASCATの発表ならびに2018年のDAWN, DEFUSE3の発表により、最近の急性期脳血栓の血栓回収術の進歩には目覚ましいものがあります。ところでこれらの臨床試験の患者選択基準は様々です。特に16時間以降の選択に灌流画像計測ソフトが必要になってきておりますが本邦ではこれがない施設が多いようで、各施設どのように患者適応を判断しているのか興味が持たれます。さて「経皮経管的脳血栓回収機器適正使用指針第3版2018年度3月」が3学会から公表されています。この指針では適応をグレードA、グレードB、グレードC1にわけて、灌流画像計測ソフトがない施設でも患者適応を判定できるようにしてあります。またこの適応について図が示されております。(文献 1,2,3,4,5,6)
このニュースでは、この図について、また最近の急性期脳梗塞の治療について小生の考えていることをまとめてみました。
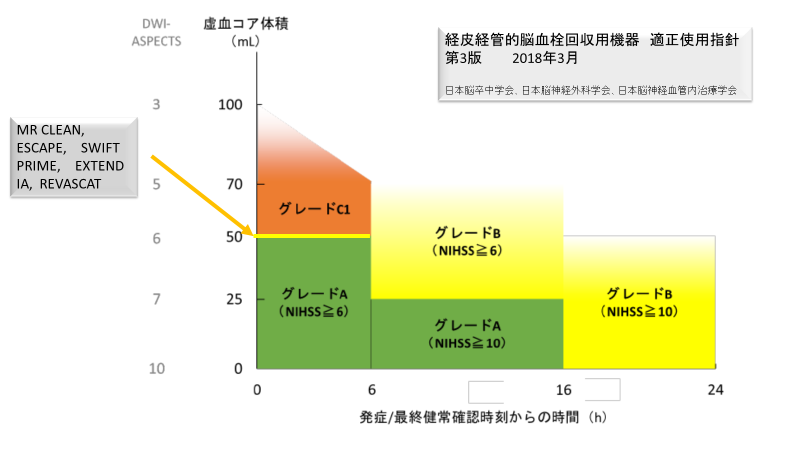
Fig.1
1.最終健常確認後6時間以内:グレードA (緑色部分)(Fig.1)
この部分は2015年に発表されたMR CLEAN, ESCAPE SWIFT PRIME, EXTEND IA, REVASCATの発表により、最終健常確認後6時間以内の血栓回収術が有効であることが科学的に証明され、この指針でグレードAとされたところです。虚血コアの部分が50ml以下となっていることまたDWI-ASPECTSで6以下になっているところですが、MR CLEAN, SWIFT PRIME, EXTEND IAの選択基準が6時間以内になっていることで6時間以内が選択され、ESCAPE SWIFT PRIME, REVASCATの選択基準がDWI-ASPECTSで6以上になっていることから決められたと考えています。
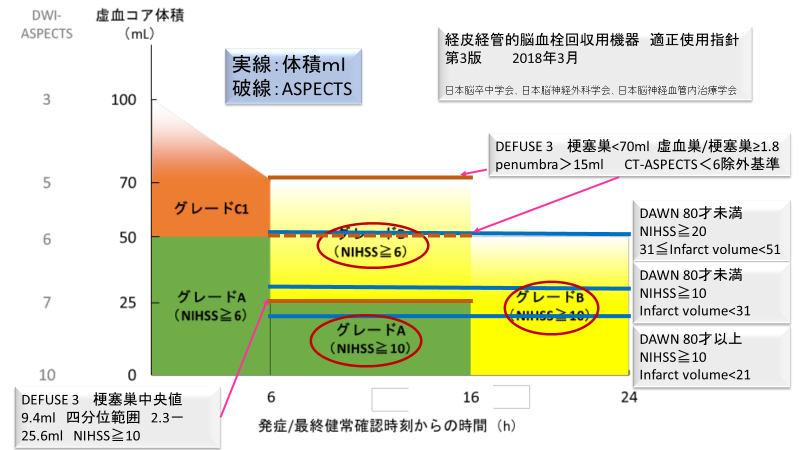
Fig.2
2.最終健常確認後6~16時間:グレードA(緑色部分)(Fig.2)
Fig.2の最終健常確認後6時間から16時間でのグレードA(緑色部分)のところですが、この部分は治療が強く勧められている領域で、血管内治療の非常に良い適応です。指針では18歳以上、発症前mRS: 0~1、CTではなくDWI-ASPECTS≧7かつNIHSS≧10となっています。これの科学的根拠はDEFUSE3の結果です。血管内治療への割り付け群の虚血体積中央値が9ml、四分位範囲(中央値の前後25%で計50%)が2.3-25.6mlで、この四分位範囲の上の値25.6mlより25mlと決定されているようです。虚血巣の25mlはDWI-ASPECTSの7点にほぼ一致しますのでこのようになっているのであろうと考えています。また血管内治療への割り付け群NIHSSの中央値は16、四分位範囲10~20となっていますので、10が採用されているものと考えています。
3.最終健常確認後6時間から16時間:グレードB(黄色部分)(Fig.2)
Fig.1の最終健常確認後6時間から16時間までのグレードBのところを見てみましょう。指針ではDWI-ASPECTS>5あるいは虚血巣<70ml以下でNIHSS≧6とされています。この決定基準にはDEFUSE3の患者選択基準が採用されています。DEFUSE3の画像の患者選択基準は梗塞巣<70ml、虚血巣/梗塞巣>1.8、ミスマッチ体積>15ml、神経症状の選択基準はNIHSS≧6となっています。そこで虚血コア体積をRAPIDのような計測ソフトで計算した場合、黄色の部分の上限となり、赤の実線を引いてみました。(引用文献 7,8)
ただしDEFUSE3の除外基準の一つにCT-ASPECTスコアが6未満となっていますので5以下は含まれません。これは赤の破線で示しました。注意点としてCT-ASPECTSとDWI-ASPECTSでは少し体積の真値が違っていることが挙げられます。またASPECTSと画像計測ソフトで計測された虚血体積との関連性には当然ズレがあり、無視できませんので、指針図のDWI-ASPECTSが5から6の上部のぼかしは、そのあたりの配慮が入っていると考えています。
4.最終健常確認後16~24時間:グレードB(黄色部分)(Fig.2)
Fig.2の最終健常確認後16時間から24時間: グレードB (黄色部分)を見てみましょう。
指針では発症前のmRSが0~1、NIHSS≧10、DWI-ASPECTS≧7でCT灌流画像またはMRI灌流画像での虚血コア体積と神経症状あるいは灌流画像での灌流遅延領域にミスマッチがある場合とされています。この部分の科学的根拠はDAWNの患者選択基準です。DAWNの選択基準では3グループありA群:≧80才、NIHSS≧10、梗塞巣体積<21ml、B群:<80才、NIHSS≧10、梗塞巣体積<31ml、C群:<80才、NIHSS≧20、梗塞巣体積<51mlとなっている。DAWNでC群を含めているので指針の図としては虚血巣50ml以下、DWI-ASPECTSでは6以下、また神経症状を80才以上のNIHSS≧10採用し黄色としています。ただし前述のごとく画像での虚血巣の体積とDWI-ASPECTSの関連性は分かっていますが当然ズレがあります。このようなことから図の上のDWI-ASPECTSが6から7の部分にぼかしが入っているだと考えています。このズレの部分は本当にむつかしいところで、画像計測ソフトがあれば問題はないのでしょうが、2019年時点ではASPECTSで決めるための科学的根拠が出ていないと考えるべきでしょう。もしこの時間帯でも計測ソフトなしに選択するとするならば、ASPECTS6=体積50mlであると信じて適応決定するしかないと思います。
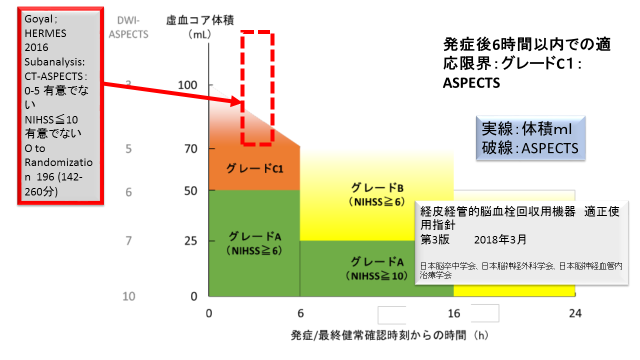
Fig.3
5.最終健常確認後6時間以内:グレードC1(オレンジ色部分)(Fig.3)
この部分は、多くの臨床試験がありますが、まだ十分な科学的根拠が示されていないところです。適正指針には、「ASPECTSが6点未満の広範囲虚血例、NIHSSスコアが6未満の軽症例、MCA M2部やBAの急性期脳動脈閉塞例、発症前mRSスコアが2以上の脳梗塞例に対して発症6時間以内に本療法を施行することは、十分な科学的根拠は示されていないが、症例ごとに適応を慎重に検討し、有効性が安全性を上回ると判断した場合には本療法の施行を考慮しても良い」と記載されています。
まず虚血コアのASPECTS 5未満はGoyalらがまとめたHERMESのサブ解析で血管内治療に有意な効果がなかった部分、ASPECTSが1~5を赤の破線四角で示しました。この指針の図で縦軸ASPECTSを連続した分布と仮定した場合ASPECTSの5と6の中間より少し5に近いところが下限と考え、破線の下の部分を決めて記入してみました。(Fig.3)(引用文献 9)
しかしながら虚血コアが大きくても急性期で血管内治療が有効であると示された報告も多くあります。Rebello等のケースコントロール研究、RESCUEJapanRegistry2の前向き登録研究のサブ解析、Manceau等の後ろ向き報告を引用しました。それをFig.4に示します。(引用文献 10,11,12)
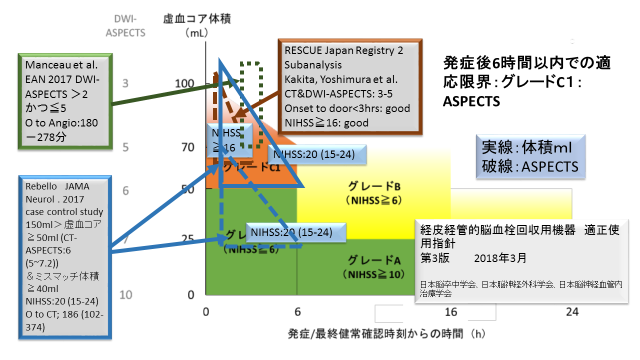
Fig.4
Rebello等の報告は虚血コアが50ml以上150ml以下の大きな梗塞巣があるがミスマッチの体積が40ml以上であれば健常確認後12時間以内の血管内治療が有効であることを示しております。この部分を青三角形(実線)で囲んでみました(元データの分布が分からないので、三角にするか楕円形にするか四角にするか台形にするか迷いましたが、三角を採用しました)。また術前のNIHSSの中央値20と95%信頼区間(15-24)を記入しました。虚血コアが測定できない施設はASPECTSで判定すると思いますので。このRebelloらの臨床研究の結果の血管内治療グループの術前CT-ASPETCTSの中央値と95%信頼区間を青三角形(破線)で示しました。また神経症状も先と同様に示しました。画像計測ソフトによる体積とASPECTSの解離が理解できるように思われます。ただしこの研究はRCTではありませんのでエビデンスの度合いが低いかもしれません。
RESCUE Japan Registry 2のサブ解析結果を見ますとCTあるいはDWIのASPECTSで3-5(ただし調整OR 2.04;95%CI 0.96-4.37なので傾向しかわかりません)、最終健常確認後3時間未満(調整OR 4.86; 95%CI 1.7-13.85)、NIHSSが16以上(調整OR 4.98 95%CI 1.9-13.05)で血管内治療の成績がいいということで、一応、茶色三角(破線)で囲んでみました。
Morceauらの後ろ向きの報告ではASPECTS5以下2未満で血管内治療の成績が良かったとしています。緑色四角(破線)で囲んでみました。彼らの報告では、時間については発症から血管造影までの時間が報告されています。他の報告のような最終発症から画像診断あるいはランダム化までとの時間と比較すると、少し遅れがあることを考慮すべきだと思います。おそらくもう少し緑四角を左にずらしたほうがいいのか知れませんがオリジナルを引用しました。またこれら3つの良好の結果を示している研究結果もRCTではありませんので科学的根拠は少し差し控えて考えたほうがいいのでしょう。指針ではグレードがC1となっています。4つの既説明の臨床試験の結果を重ねた図をFig.5 として下に示しました。
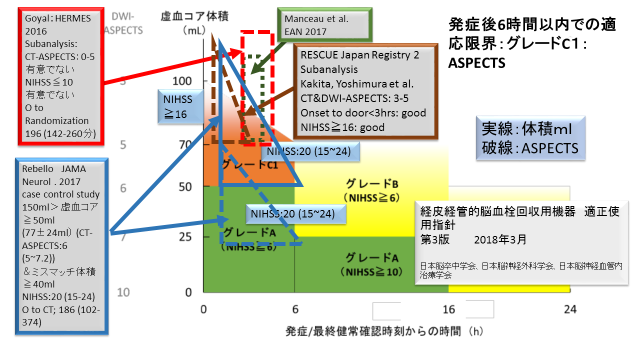
Fig.5
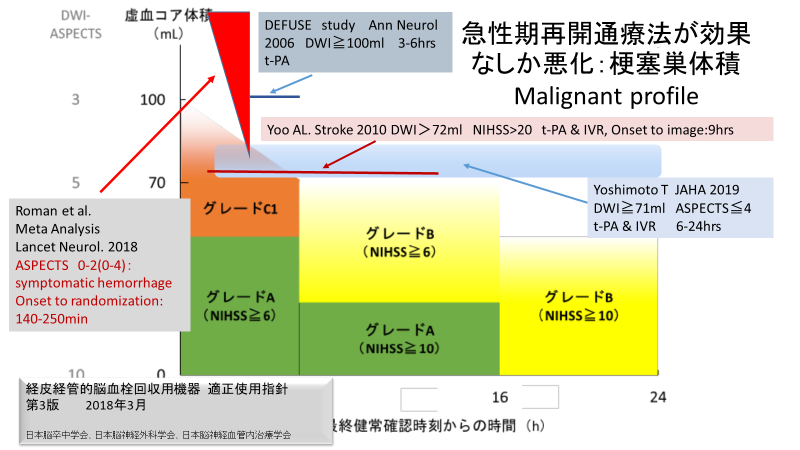
Fig.6
6.血管内治療が悪影響を与える場合(Fig.6)
ところでいろいろな研究結果より、血管内治療をすれば出血などの悪影響が出てくる場合も報告されております。Roman等のメタ分析、DEFUSE study、Yooらの報告、Yoshimoto等の報告を適正指針図に重ねてみました。この部分は血管内治療を行ってはいけないであろうと推測される部分です。(引用文献 13,14,15,16)
7.まとめ(Fig.7,8,9)
今まで述べてきた事柄をまとめますと、もし自分の施設に画像計測ソフトがありこれを活用するのであればFig.7の藍色の実線で示した曲線が患者選択の限界基準になるように思われます。
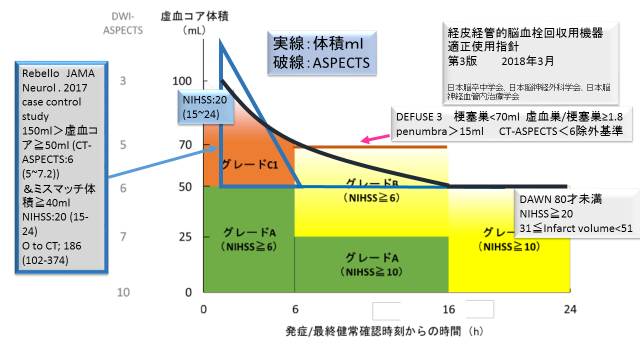
Fig.7
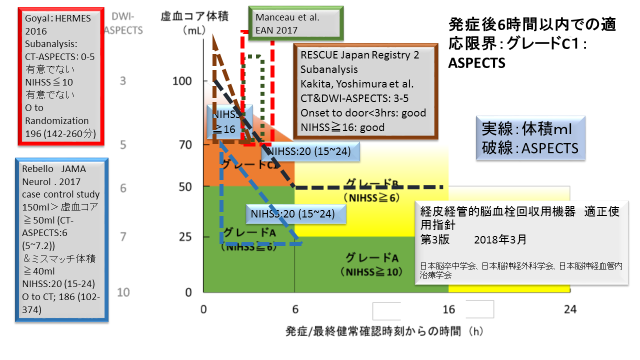
Fig.8
自施設に画像計測ソフトがなくASPECTSで患者選択を行う場合には、Fig.8 の藍色の破線のようになるものと推測されます。16時間以降24時間までについては科学的根拠がなく線が引けません。もしこの時間帯でも計測ソフトなしに選択するとするならば、ASPECTS6=体積50mlであると信じて決定するしかないと思います。
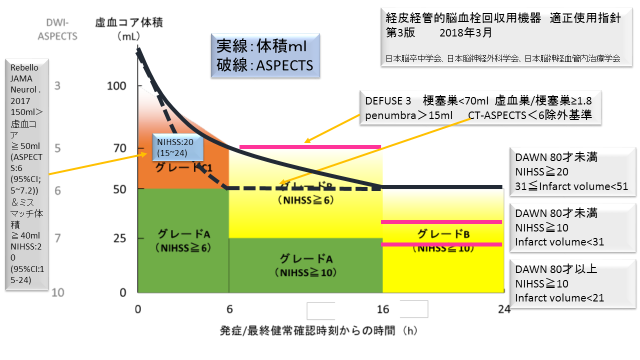
Fig.9
以上、長々と述べてきたことを適正指針の図を利用して、最終的にまとめて図示(Fig.9)すると、画像ソフトで計測する場合には藍色の実線、CTあるいはDWI-ASPECTSで適応を決める場合には藍色の破線になるのかなと考えています。ピンクの実線はDEFUSE3とDAWNの選択基準を参考に入れました。これからも多くの臨床試験の報告がなされると思いますしより正確な基準線が引けることを期待しています。
なお、本ニュース記事の文献の引用には注意をしましたが、元データの分布が分からないので、三角や四角の図形など適当に決めております。このようなことで、かえって真実から離れてしまっているかもしれません。いろいろ理解不足や誤った解析も含んでいると思いますのであくまで私見とご了解ください。
【引用文献】
- 経皮経管的血栓回収機器適正使用指針 第3版 2018年3月
- Berkhemer OA., et al. for the MR CLEAN Investigators: A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 2015; 372: 11-20.
- Goyal M, et al.; the ESCAPE Trial Investigators. Randomized Assessment of Rapid Endovascular Treatment of Ischemic Stroke. N Engl J Med 2015; 372: 1019-30.
- Saver JL, et al.; SWIFT PRIME Investigators. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372: 2285-95
- Campbell BC, Mitchell PJ, Kleinig TJ, et al; EXTEND-IA Investigators. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med. 2015; 372(11): 1009-1018
- Jovin TG et al for the REVASCAT trial investigators: Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med. 2015; 372: 2296-306
- Albers GW, Marks MP, Kemp S, et al; DEFUSE 3 Investigators.; Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med. 2018 Feb 22; 378(8): 708-718
- Nogueira RG., Jadhay AP., Haussen DC.; Thrombectomy 6 to 24 Hours after Stroke with a Mismatch between Deficit and Infarct. N Engl J Med. 2018 Jan 4; 378(1):11-21
- Goyal M, et al.; HERMES collaborators. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomized trials. Lancet 2016; 387: 1723-31
- Rebello LC. Et al.; Endovascular treatment for patients with acute stroke who have a large ischemic core and large mismatch imaging profile. JAMA Neurol. 2017 Jan 1; 74(1):34-40
- Kakita H., Yoshimura S., et al.; Impact of endovascular therapy in patients with large ischemic core. Stroke 2019; 50: 901-908
- Manceau PF., Soize S., et al.; Is there a benefit of mechanical thrombectomy in patients with large stroke (DWI-ASPECTS≦5) Euro J Neurol. 2018; 25: 105-110
- Albers GW, Thijs VN., et al.; Magnetic resonance imaging profiles predict clinical response to early reperfusion: the diffusion and perfusion imaging evaluation for understanding stroke evolution (DEFUSE) study. Ann Neurol. 2006 Nov; 60 (5): 508-517
- Roman S, et al.; Imaging features and safety and efficacy of endovascular stroke treatment: a meta-analysis of individual patient-level data. Lancet Neurology, 17(10), pp. 895-904
- Yoo AJ., Barak ER., Copen WA., et al., Combining acute diffusion-weighted imaging and mean transmit time lesion volume with national institutes of health stroke scale score improves the prediction of acute stroke outcome. Stroke 2010; 41 (8): 1728-1735
- Yoshimoto T., Inoue M., Yamagami H., et al.: Use of diffusion-weighted imaging-Alberta stroke program early computed tomography score (DWI-ASPECTS) and ischemic core volume to determine the malignant profile in acute stroke. J Am Heart Associ. 2019 19; 8 (22) e012558
文責 滝 和郎(脳卒中センター長)
